



 lo largo de los años, el interés en la ERM de ¹H ha crecido rápidamente y en la actualidad es más común que la ERM de ³¹P. Otros núcleos como el ¹³C y ¹⁹F son también cada vez más accesibles en equipos estándar.
lo largo de los años, el interés en la ERM de ¹H ha crecido rápidamente y en la actualidad es más común que la ERM de ³¹P. Otros núcleos como el ¹³C y ¹⁹F son también cada vez más accesibles en equipos estándar.
La Tabla 05-02 muestra algunas propiedades importantes de una selección de núcleos de interés en estudios biológicos.
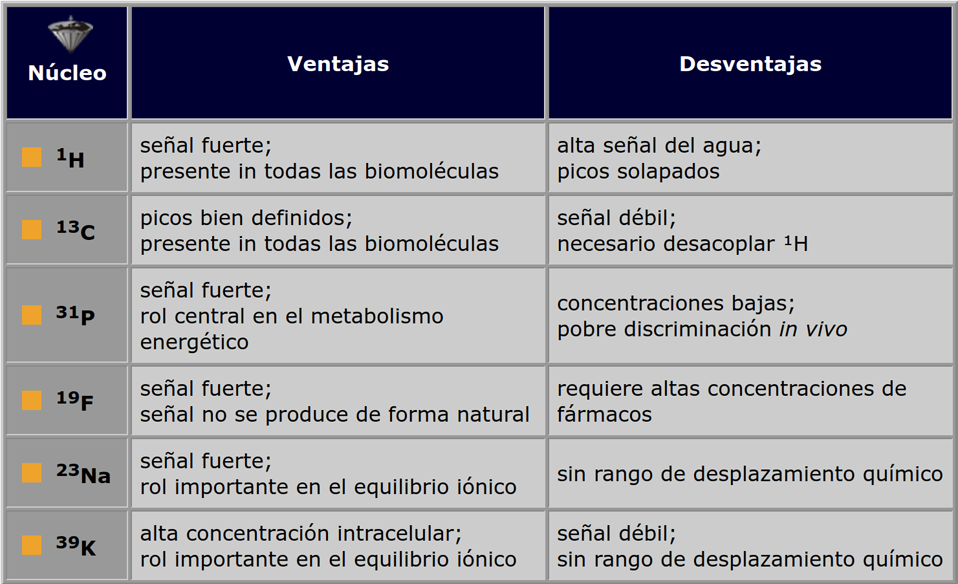
Tabla 05-02:
Ventajas y desventajas de una selección de núcleos para la espectroscopia por RM.
El número cuántico de espín, n, es una propiedad fundamental de los núcleos atómicos. Entre otras cosas, se conoce que los espines nucleares pueden ocupar 2n+1 niveles energéticos, por lo que núcleos con un espín de 1/2 tienen dos estados energéticos posibles, mientras que núcleos con un espín de 3/2 tienen 4 posibles niveles energéticos.
Los núcleos con espines mayores a 1/2 se conocen también como cuadrupolares. Una característica importante de los núcleos cuadrupolares es que su relajación es sensible a los campos eléctricos fluctuantes, así como a los campos magnéticos fluctuantes, por lo que sus tiempos T1 y T2 son mucho más cortos que aquellos en los núcleos con espín 1/2.
Dado que se quiere tanta señal como sea posible, es deseable que un núcleo tenga una alta sensibilidad, aunque la abundancia natural es también importante.
Las sensibilidades relativas de ³¹P y ¹³C difieren en un factor de alrededor de 4, pero el hecho de que el ³¹P tenga una abundancia natural del 100% y el ¹³C sólo del 1.1% (i.e., alrededor del 98.9% de los núcleos de carbono son el isótopo ¹²C, que es no magnético) hace que las sensibilidades absolutas difieran en alrededor de 400 unidades (Tabla 05-03).
Alternativamente, los núcleos de ³⁹K son alrededor de 31 veces menos sensibles que los núcleos de ¹³C, pero dado que el ³⁹K tiene una abundancia natural del 93% y el ¹³C del 1.1%, una muestra que contenga potasio producirá una señal más intensa que una muestra de carbono a concentración similar.
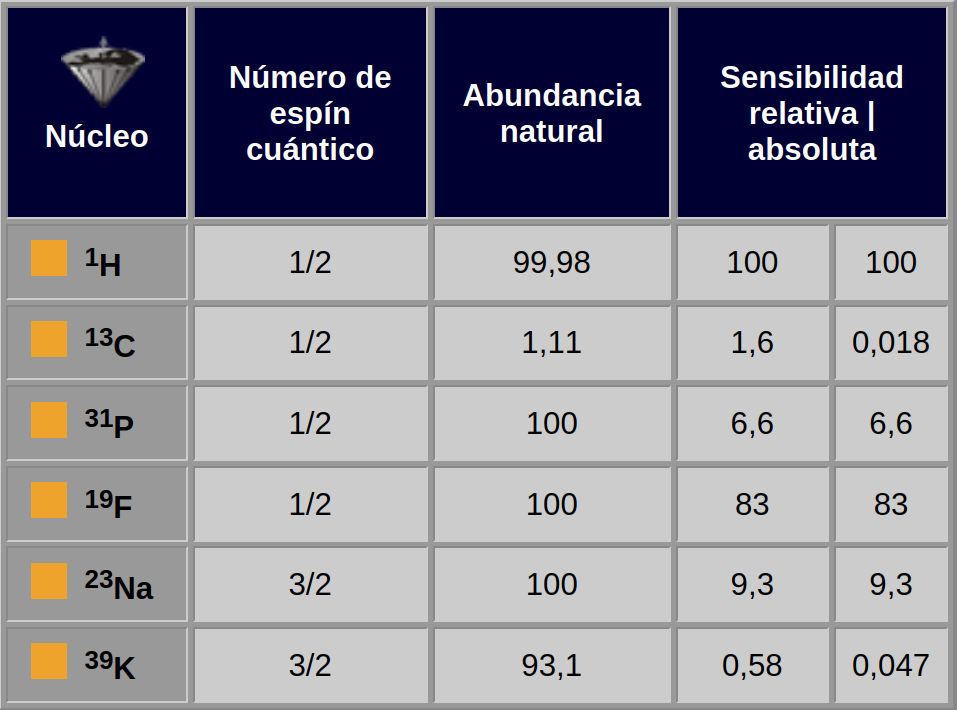
Tabla 05-03:
Propiedades de RMN importantes de una selección de núcleos utilizados en espectroscopia por RM in vivo.
Los estudios de ¹H se han ido extendiendo cada vez más a medida de que las dificultades técnicas se han superado y también a la vez que el interés se ha ido centrando más en áreas del metabolismo que carece de metabolitos fosforilados (Figura 05-06). El ¹H posee la respuesta más intensa de todos los núcleos atómicos, y se encuentra en prácticamente todos los compuestos bioquímicos. Por lo tanto, es un buen núcleo para monitorear el metabolismo [⇒ Gadian 1990, ⇒ Matson 1999, ⇒ Miller 1991].

Figura 05-06:
Espectro de protones de un cerebro humano normal. PCr: (fosfo) creatina; PCho: (fosfo) colina; NAA: N-acetilaspartato.
Sin embargo, existen algunas limitaciones técnicas. Probablemente el principal inconveniente de la ERM de ¹H es la elevada señal del agua en los tejidos. Si asumimos un porcentaje bastante conservador de agua en los tejidos, como por ejemplo un 65%, la concentración molar de agua aproximada será de 36 M. Dado que existen 2 núcleos de ¹H en cada molécula de agua, la concentración de ¹H será de más de 70 M.
Los metabolitos que queremos estudiar poseen una concentración máxima de 10 mM o menor, que es al menos 7000 veces inferior que la señal de agua. Por lo tanto, se necesitan métodos especiales para reducir el tamaño de la señal de agua a un nivel comparable al de los metabolitos. El método más simple es utilizar un pulso de saturación de frecuencia selectiva largo, pero aunque éste método resulta muy efectivo in vitro, puede conllevar a un calentamiento del tejido inaceptable en adquisiciones in vivo.
Se pueden utilizar múltiples secuencias de pulsos, como por ejemplo las secuencias de pulsos binomiales para reducir la señal del agua. Si no se excitan los núcleos de ¹H en agua, no podrán proporcionar señal.
Otro método de supresión de agua explota las características de la curva de relajación T1. Se utiliza un pulso selectivo de 180° para invertir la magnetización del agua. Al principio la magnetización será elevada y de signo negativo, pero los procesos de relajación la llevarán a su estado de equilibrio. Después de 0,69 × T1 del agua, la magnetización del agua será aproximadamente nula. En este punto un pulso de excitación de 90° producirá una señal relativamente elevada de los metabolitos y una señal bastante reducida del agua.
Estos métodos también se aplican en la imaginería por RM (cf. Capitulo 11).
Si estuviéramos utilizando una secuencia de pulsos espín-eco en combinación con un método de selección de volumen parcial, podría adecuarse para que el eco se formara en el instante apropiado después del pulso de inversión selectivo para producir una mínima señal del agua.
Otro de los problemas de la ERM de ¹H es la estrecha dispersión de los picos del espectro. La mayoría de picos se encuentran en un rango de frecuencias relativamente estrecho, con lo que existe gran cantidad de solapamiento. Esta limitación puede compensarse si se trabaja a campos magnéticos más elevados, pero aunque existen los sistemas de campo magnético ultra-alto para cuerpo completo, la mayoría de adquisiciones de ERM se realizan en equipos de 1,5 y 3 Tesla, en los que la imagen por RM impone el campo magnético necesario en lugar de la ERM.
Las principales aplicaciones clínicas de la ERM de ¹H en el cerebro humano incluyen el estudio de la epilepsia, lesiones ocupantes de espacio, esclerosis múltiple, enfermedades neurodegenerativas como el Alzheimer, el Parkinson y Huntington, la hipoxia y otras enfermedades metabólicas. En 2014, Öz y numerosos coautores de diferentes centros publicaron un buen resumen y revisión de la ERM de 1H clínica de desórdenes del sistema nervioso central [⇒ Öz 2014]. Existen también otras enfermedades que se han estudiado mediante ERM de protón, especialmente enfermedades del sistema muscular.
Al contrario que en el ¹H y ³¹P, el isótopo del carbono magnéticamente activo, ¹³C, no es la forma más abundante del núcleo. El ¹³C puede encontrarse en prácticamente todos los compuestos bioquímicos y las señales por tanto presentan una gran dispersión, es decir, ocurren a lo largo de un gran rango de frecuencias, por lo que el número de solapamientos entre picos es reducido.
El inconveniente más importante del ¹³C es la extremadamente débil señal y los problemas de acoplamiento ¹³C-¹H. En un espectro de ¹³C acoplado a ¹H, la mayoría de picos se encontrarán divididos en dos o más picos de menor tamaño, lo que complica el espectro y reduce la relación señal-a-ruido. El efecto del acoplamiento puede eliminarse mediante la utilización de técnicas de desacoplamiento. La solución más simple es la irradiación directa a la frecuencia de resonancia del protón, aunque in vivo puede conllevar excesivo calentamiento de los tejidos.
Existen varios tipos de técnicas de pulsos que son tan efectivas como la irradiación directa pero que utilizan una fracción de la potencia. La necesidad de desacoplar en la ERM de ¹³C se traduce en que el equipo debe poder operar 2 canales de manera simultánea, lo que incrementa la complejidad y también el coste.
 Una ventaja de la ERM de ¹³C es que podemos hacer estudios de marcaje. Mediante la administración de compuestos marcados con ¹³C a un animal o paciente, se pueden seguir las señales fuertes y particulares del compuesto marcado y analizar su metabolización en el cuerpo. Dado que cada posición del carbono en una molécula producirá una señal característica, el experimento con marcaje puede utilizare para seguir no sólo qué moléculas terminan con el marcaje sino también la posición exacta en la que terminan.
Una ventaja de la ERM de ¹³C es que podemos hacer estudios de marcaje. Mediante la administración de compuestos marcados con ¹³C a un animal o paciente, se pueden seguir las señales fuertes y particulares del compuesto marcado y analizar su metabolización en el cuerpo. Dado que cada posición del carbono en una molécula producirá una señal característica, el experimento con marcaje puede utilizare para seguir no sólo qué moléculas terminan con el marcaje sino también la posición exacta en la que terminan.
Esta información es de gran utilidad en el análisis de qué rutas bioquímicas se utilizaron en el proceso de conversión de una molécula en otra. Estudios de etiquetado similares no son posibles con ¹H y ³¹P porque ya son 100% abundantes. Desgraciadamente, el etiquetado por EMR de ¹³C es bastante costoso.
La ERM de ¹³C puede detectar señales de azúcares, lípidos y glicógeno en el hígado y músculo. Puede además proporcionar información sobre el balance de carbono en el metabolismo energético, que es complementaria a la información que se puede obtener por ERM de ³¹P sobre el metabolismo energético [⇒ Matson 1999, ⇒ Shulman 1990].
Una aplicación prometedora de la espectroscopia de ¹³C es el análisis de fluidos del cuerpo humano, como la sangre y la orina. Esto puede realizarse incluso de manera rutinaria con espectrómetros de RMN analíticos de muy alto campo. La espectroscopia de protón también puede usarse con este mismo propósito.
El ¹⁹F proporciona una señal de RM intensa y es abundante al 100%. Los estudios con flúor se han realizado sobre todo para analizar el metabolismo de los fármacos que contienen flúor. Dado que no existen señales naturales de flúor en el cuerpo, todas las señales de flúor deben provenir del fármaco o sus metabolitos.
El inconveniente de la ERM de flúor es que a pesar de la intensa señal, seguimos necesitando concentraciones del fármaco en el orden de 1-10 mM en los tejidos, que es una concentración bastante elevada para la mayoría de estos fármacos.
La frecuencia de resonancia del flúor se encuentra cercana a la del ¹H en el mismo campo magnético, y es posible en ocasiones realizar estudios de 19F en el canal de ¹H del equipo de ERM sin la necesidad de realizar grandes modificaciones.
El ²³Na y el ³⁹K difieren de los otros núcleos mencionados en que no tienen número de espín 1/2. Ambos presentan un número de espín de 3/2 y son por lo tanto núcleos cuadrupolares. Ambos son isótopos con elevada abundancia (el sodio es 100% abundante y el potasio es 93.1% abundante).
El sodio está altamente concentrado en el entorno extracelular, mientras que el potasio se encuentra altamente concentrado en el medio intracelular. Ambos tienen un papel muy importante en el balance iónico. Una gran diferencia entre los dos es que el sodio produce una señal relativamente intensa, comparable a la del fósforo, mientras que el potasio produce una señal débil. La sensibilidad absoluta del potasio es alrededor de 3 veces la del ¹³C, pero la señal del potasio es mucho más ancha que la del ¹³C, ya que el T2 del potasio es muy corto. Esto se debe al efecto de la relajación cuadrupolar, que reduce la relación señal-a-ruido de los picos.
El ³⁹K tiene además una muy baja frecuencia de resonancia, lo que aumenta la complejidad técnica del experimento. Se han realizado estudios en animal con potasio en equipos de 4,7 Tesla, pero no hay constancia de que se haya estudiado en equipos de 1,5 Tesla. Aunque el sodio tiene también una señal relativamente ancha debido a los efectos cuadrupolares, la mayor intensidad de señal de este átomo permite obtener espectros de calidad razonable.
Desafortunadamente, el ²³Na y ³⁹K o tienen una dispersión natural por desplazamiento químico. En otras palabras, la totalidad de la señal de una muestra in vivo viene en la misma frecuencia. Existen algunos métodos para separar el desplazamiento químico del sodio y del potasio intracelular del extracelular utilizando reactivos de desplazamiento químico (parecidos a los medios de contraste utilizados para la obtención de imágenes), pero los estudios están actualmente restringidos a células y animales [⇒ Kohler 1991, ⇒ Matson 1999, ⇒ Rashid 1991].