



![]() os que realizan espectroscopia de RM de alta resolución han medido valores de T1 desde mediados del siglo pasado. Estas mediciones se pueden hacer de diferentes maneras con diferentes grados de precisión — in vitro (ex vivo) and in vivo.
os que realizan espectroscopia de RM de alta resolución han medido valores de T1 desde mediados del siglo pasado. Estas mediciones se pueden hacer de diferentes maneras con diferentes grados de precisión — in vitro (ex vivo) and in vivo.
Las mediciones in vitro se realizan sobre muestras pequeñas, de entre 0.1-1.0 ml o ligeramente más grande, en el interior de un campo magnético extremadamente homogéneo.
Varios métodos han sido desarrollados para conseguir la máxima precisión con el mínimo consumo de tiempo. Típicamente se llevan a cabo de 15 a 30 mediciones de magnetización sobre la muestra con diferentes retardos de tiempo, TI en los experimentos de recuperación-inversión o TR en experimentos de saturación parcial. Basándose en estos resultados se calcula un valor T1 con límites de error generalmente menores al 5%.
T2 puede calcularse con una sola secuencia multi-eco. Cuantos más ecos se utilicen mayor será la precisión de la medición.
Los cálculos basados en secuencias de pulsos rápidas (las llamadas secuencias de caja negra) resultan en estimativos aproximativos de los valores de T1, T2 y T2* (y la densidad de protones). Es posible que puedan reproducirse al repetirse, pero el uso de valores del tiempo de relajación adquiridos con tales secuencies de pulso no es aconsejable para realizar comparaciones científicas o clínicas.
Los equipos magnéticos de mayor diámetro permiten examinar organismos, animales y personas en su totalidad, al igual que una determinación más fisiológica de los valores del tiempo de relajación que lo que es posible en órganos o tejidos extirpados.
Las mediciones del tiempo de relajación se consideraron de mucha importancia en los primeros años a partir de la comercialización (para medicina) de la imaginería por RM. Todas las máquinas se programaron para crear imágenes reales de T1 y T2 (es decir, para el mapeo de T1 y T2), basadas en secuencias SE e IR.
Muy temprano, en el marco de un proyecto europeo extenso, se introdujeron objetos de prueba y los protocolos para su uso que permitían medir T1 y T2 con precisión y exactitud. Los hallazgos fueron asombrosos pero científicamente predecibles [⇒ EEC 1988].
En particular, la exactitud y precisión con las que podían medirse los tiempos de relajación T1 y T2 fueron desilusionantes. Se hicieron pequeños estudios de comparación y se encontró que los valores de tiempos de relajación no eran la tan valiosa adición en diagnóstico que se pretendía. Finalmente esta aplicación "estándar" se omitió [⇒ Lerski 1988].
Una prueba multi-centro similar se repitió más de 30 años después. Estudios fantasmas – recientemente introducidos en los E.E.U.U. – describieron la misma falta de precisión y reproducibilidad de las mediciones de T1 adquiridas en diferentes máquinas de IRM, faltas que eran aún más pronunciadas cuando se usaban técnicas rápidas para estimar las constantes de relajación [⇒ Keenan 2021] (ver también: Técnicas rápidas para estimación de relajación).
 Localización. Uno de los principales problemas de las mediciones del tiempo de relajación in vivo es la localización del volumen a ser estudiado.
Localización. Uno de los principales problemas de las mediciones del tiempo de relajación in vivo es la localización del volumen a ser estudiado.
La precisión real de las mediciones in vivo depende del número de datos puntuales adquiridos y de la calidad de la localización. En órganos pequeños o inmóviles, como el cerebro, la localización es relativamente fácil, pero en órganos con patrones de movimiento complejos, como el corazón, se hace exigente y casi imposible (en especial en campos altos y ultra-altos).
Los detalles acerca de las técnicas de localización se dan en el Capítulo 6.
 Cálculo de valores del tiempo de relajación y la densidad de protones. El método actual y más confiable para obtener una imagen T1 (mapa T1), es decir una imagen cuyos elementos representen los valores puros de valores de T1, se basa en una manipulación matemática de imágenes con diferentes influencias de T1 obtenidas por separado. Las mediciones son más fáciles y exactas en campos bajos y medios porque en estos campos los valores de T1 son más cortos, la sincronización con ECG es menos complicada y los artefactos son menos pronunciados.
Cálculo de valores del tiempo de relajación y la densidad de protones. El método actual y más confiable para obtener una imagen T1 (mapa T1), es decir una imagen cuyos elementos representen los valores puros de valores de T1, se basa en una manipulación matemática de imágenes con diferentes influencias de T1 obtenidas por separado. Las mediciones son más fáciles y exactas en campos bajos y medios porque en estos campos los valores de T1 son más cortos, la sincronización con ECG es menos complicada y los artefactos son menos pronunciados.
Típicamente se utilizan de dos a cuatro imágenes y sus señales se procesan matemáticamente para calcular los valores de T1 puros. Teniendo en cuenta que la relajación in vivo puede ser multiexponencial un ajuste limitado a una curva exponencial sería inadecuado.
Las imágenes T2 se calculan a partir de las imágenes de una serie multi-eco, e.g., CPMG. En el ámbito clínico se aplican por lo general cuatro u ocho ecos.
La difusión, el flujo y los decaimientos multiexponenciales casi nunca se tienen en cuenta en los ajustes y el ruido los artefactos de movimiento contribuyen a las inexactitudes.
 El tamaño de la matriz y grosor del corte, así como los efectos del volumen parcial, son factores limitantes para las mediciones del tiempo de relajación in vivo. Las variaciones en la misma lesión relacionadas con vascularización, necrosis y comportamiento celular (compartimentalización macroscópica) contribuyen a la superposición de los valores de los tiempos de relajación.
El tamaño de la matriz y grosor del corte, así como los efectos del volumen parcial, son factores limitantes para las mediciones del tiempo de relajación in vivo. Las variaciones en la misma lesión relacionadas con vascularización, necrosis y comportamiento celular (compartimentalización macroscópica) contribuyen a la superposición de los valores de los tiempos de relajación.
Todos los métodos que dependen de cortes a través del objeto examinado tendrán como fuente de error adicional los efectos de volumen parcial de los bordes de los cortes. El único método que evita este problema es la verdadera adquisición de imágenes en volumen 3D.
Otras posibles fuentes de error son la desviación estándar de los ajustes, los artefactos y las variaciones en la selección de elementos del volumen hechas por los operarios (Figura 04-21).
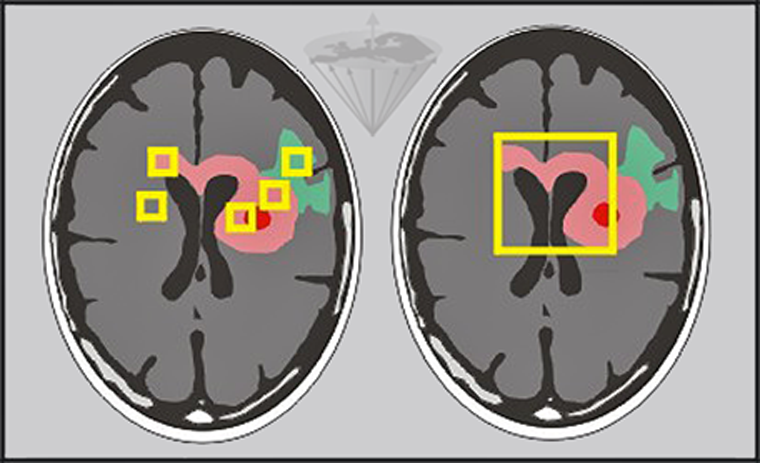
Figura 04-21:
Se pueden hacer mediciones de los tiempos de relajación in vivo ya sea pixel por pixel o por regiones de interés de diferente tamaño.
Izquierda: Pequeñas regiones de interés en edema (verde), tumor (rosado) y necrosis (rojo) y otras patologías.
Derecha: Una región más grande que cubre las principales partes del tumor.
Además, lesiones similares pueden tener más de un tiempo de relajación exponencial, e.g., los tumores cerebrales y las placas de esclerosis, lo cual no es inesperado teniendo en cuenta la naturaleza heterogénea de los tumores — y de los tejidos en general.
La reproducibilidad de estas mediciones también es limitada.
 La complejidad en varios niveles de los factores y rasgos que afectan y crean cambios en el tiempo de relajación y la distribución de protones aún no se ha entendido en su totalidad [⇒ Springer 2014]. Una visión simplificada propuesta por Koening sugiere que las moléculas de agua pueden deambular extensamente a través de las regiones intra- y extracelulares del tejido a causa de la difusión térmicamente inducida, y que la exploración es bastante exhaustiva en un tiempo del orden de T1 (y aún de T2).
La complejidad en varios niveles de los factores y rasgos que afectan y crean cambios en el tiempo de relajación y la distribución de protones aún no se ha entendido en su totalidad [⇒ Springer 2014]. Una visión simplificada propuesta por Koening sugiere que las moléculas de agua pueden deambular extensamente a través de las regiones intra- y extracelulares del tejido a causa de la difusión térmicamente inducida, y que la exploración es bastante exhaustiva en un tiempo del orden de T1 (y aún de T2).
Otro concepto es el agua altamente estructurada, limitada por un tiempo significativo en una geometría definida por diferentes constituyentes iónicos y moleculares del citoplasma [⇒ Koenig 1985, 1988].
Sin embargo, algunos rasgos de la dispersión de T1 no concuerdan fácilmente con estos conceptos, por ejemplo los fenómenos de relajación cruzada que llevan a caídas cuadripolares en el trazado de la dispersión de T1. Estos dependen de la fuerza del campo y de la temperatura (Figura 04-22) [⇒ Rinck 1988]. Más detalles acerca de la dependencia de los tiempos de relajación en la fuerza de campo y su influencia en el contraste se pueden encontrar en el Capítulo 10.
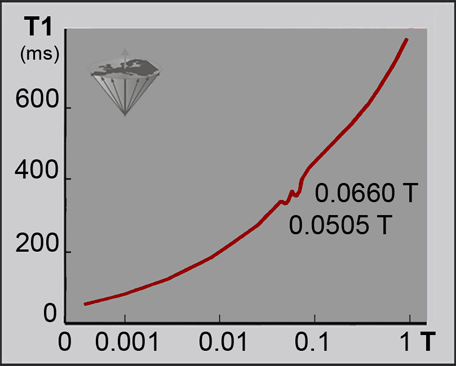
Figura 04-22:
La dispersión de T1 en los tejidos (ms) en relación con la fuerza de campo (log Tesla) no es tan monotónica y suave como se muestra por ejemplo en las Figuras 04-04 y 10-16.
Esta curva de alta resolución de la dispersión de la relajación magnética nuclear (NMRD, por su nombre en inglés) de una muestra de tejido de esclerosis múltiple revela dos caídas (cuadripolares) en 0,0505 y 0,660 T (2,1 y 2,8 MHz) en donde se interrumpe el incremento constante de T1.
Los valores del tiempo de relajación y de la densidad de protones pueden utilizarse para crear imágenes sintéticas o simuladas con fines de entrenamiento y enseñanza.
En la rutina clínica, la gente suele hablar de imágenes T1, T2 o de densidad de proton. Los términos correctos deben ser imagen ponderada (o dependiente) en T1, ponderada (o dependiente) en T2 y de densidad de protones ponderada en (ρ) (o mejor, de ponderación intermedia) debido a que estas imágenes tienen sólo un cierto grado de dependencia en T1, T2 o densidad de protones. No son imágenes calculadas de tiempos de relajación o densidad de protones puras. En el Capítulo 10 se explican estos conceptos en detalle.
Se pueden comparar las Figuras 04-23c y d, que son imágenes potenciadas en T1 y T2, con las imágenes T1 y T2 puras de las Figuras 04-23a y b.
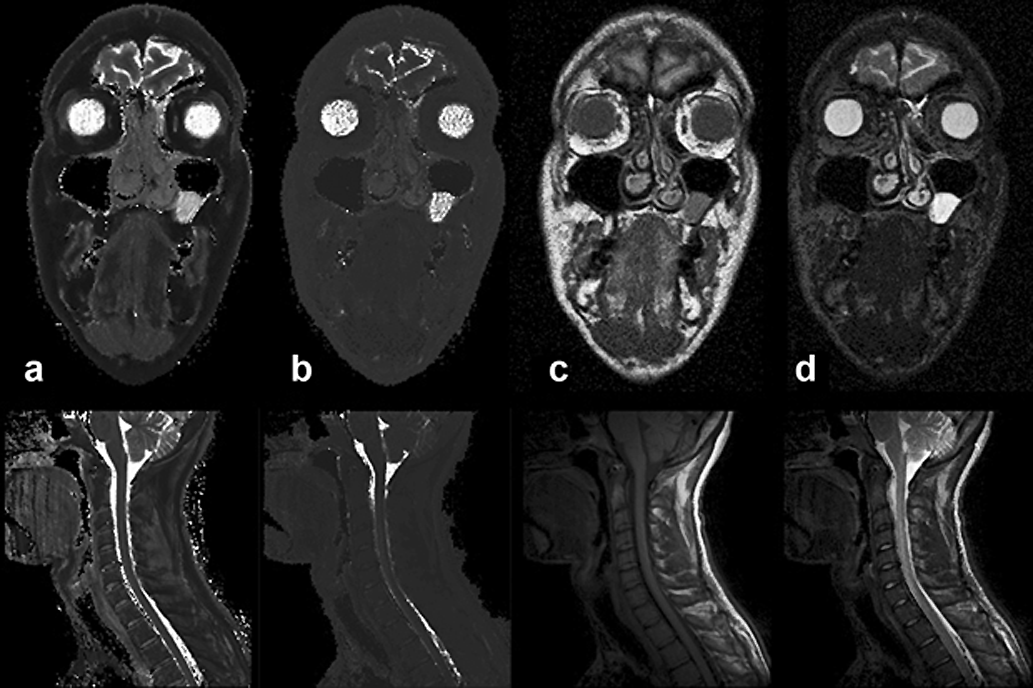
Figura 04-23:
(a) Imagen T1 calculada (pura), and (b) imagen T2 calculada (pura). Las Figuras (c) y (d) muestran imágenes ponderadas en T1 y T2, respectivamente.
Arriba: Imágenes de un paciente con un pólipo en la fosa paranasal izquierda.
Abajo: Imágenes de columna cervical.
Las imágenes puras de T1 y T2 tienen un valor de diagnóstico muy limitado. Las imágenes ponderadas con múltiples parámetros tienen un valor mucho mayor para el diagnóstico clínico y son comúnmente usadas en estudios de pacientes.
Simulación con el software MR Image Expert®