



 uince años después de la primera descripción del diferente comportamiento de relajación de los tejidos por Erik Odeblad [⇒ Odeblad 1955], algunos investigadores comenzaron a postular que los tiempos de relajación permitían diferenciar tumores de tejidos normales, ya que la mayoría de los valores T1 (y de una manera semejante T2) de tejidos patológicos pueden diferir notablemente del T1 de los tejidos similares normales [⇒ Damadian 1971] (Capítulo 20: Historia de la IRM ).
uince años después de la primera descripción del diferente comportamiento de relajación de los tejidos por Erik Odeblad [⇒ Odeblad 1955], algunos investigadores comenzaron a postular que los tiempos de relajación permitían diferenciar tumores de tejidos normales, ya que la mayoría de los valores T1 (y de una manera semejante T2) de tejidos patológicos pueden diferir notablemente del T1 de los tejidos similares normales [⇒ Damadian 1971] (Capítulo 20: Historia de la IRM ).
Sin embargo la capacidad de discriminar el tipo de tumores o su grado usando los valores de tiempo de relajación sigue siendo un sueño a pesar de los sofisticados avances en el ajuste de puntos múltiples introducidos en los últimos años. La Figura 04-24 muestra que hay diferencias, en este caso entre el T2 de los tejidos normales y el de los enfermos [⇒ Rinck 1985]. Aunque los valores de T2 son más precisos que los de T1 porque se utilizan más puntos para su cálculo, estas diferencias no son significativas entre los valores de T2 de, por ejemplo, tumores, edema o infarto.
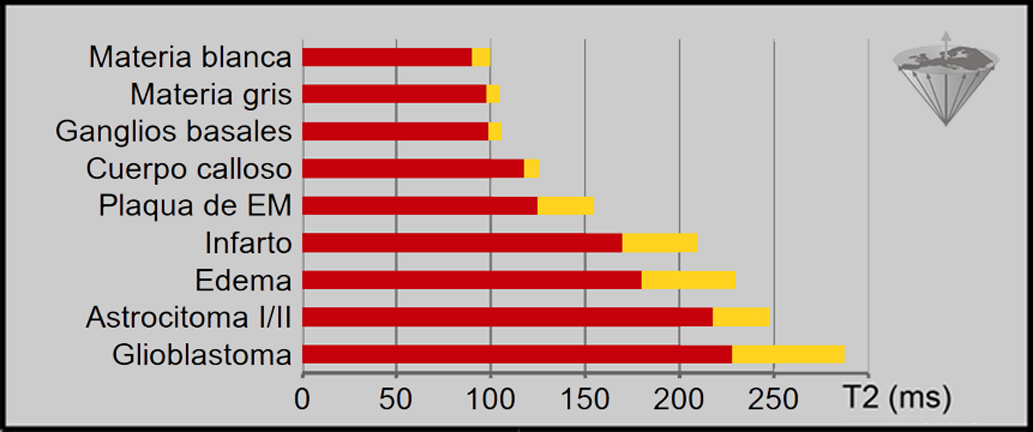
Figura 04-24:
Valores de T2 de tejidos normales y patológicos del cerebro humano medidos a 0,15 Tesla basado en 24 ecos. La desviación estándar (SD) se presenta en amarillo. La SD de los tejidos normales puede alcanzar un 20%, la de los tejidos patológicos un 30%.
Todos los años, la literatura anuncia nuevos intentos de sacar partido a la medición del tiempo de relajación in vivo. Hay algunos informes positivos acerca de su uso. La mayor parte se refieren al seguimiento durante el tratamiento, siendo los propios pacientes la referencia.
Las publicaciones incluyen, por ejemplo, un informe de que los tiempos de relajación en la médula ósea leucémica se puede utilizar para el diagnóstico diferencial de esta enfermedad (Figura 04-25) [⇒ Jensen 1990]. Otro grupo de investigación ha publicado resultados similares en gliomas de alto grado [⇒ Boesiger 1990].
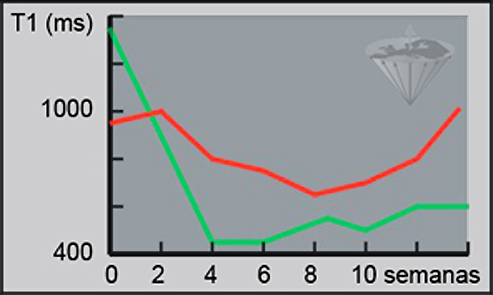
Figura 04-25:
Mediciones de T1. Seguimiento del tratamiento de leucemia mieloblástica aguda.
Respondedor: verde; no-respondedor: rojo.
Sin embargo, el seguimiento del tratamiento en base a los valores del tiempo de relajación es difícil y, en la mayoría de los casos, de dudosa fiabilidad (Figura 04-26). Un incremento y subsecuente decremento de los valores del tiempo de relajación posterior a una intervención local puede de hecho indicar edema e inflamación más que un tratamiento exitoso [⇒ Zhang 2014].
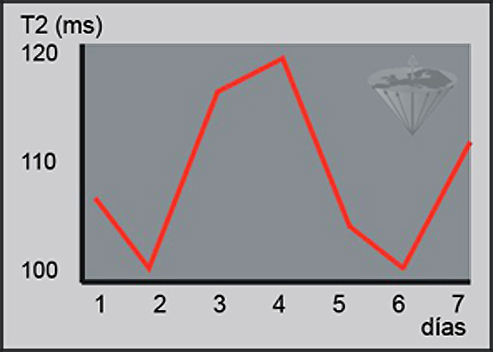
Figura 04-26:
Las mediciones de los tiempos de relajación en muestras idénticas bajo condiciones idénticas pueden mostrar grandes desviaciones estándar, como se muestra en este ejemplo.
Las mediciones in vivo para evaluar un tratamiento son de dudosa fiabilidad. Solo en algunos casos se observan cambios tan masivos que permitan una evaluación positiva.
Otros estudios han trabajado con el mapeo pixel-a-pixel de los tiempos de relajación de la materia blanca cerebral de apariencia normal en pacientes con esclerosis múltiple (EM). Los resultados sugieren que podrían existir cambios invisibles y diminutos en la materia blanca, lo que podría explicar déficits en la función cerebral que no se pueden explicar por el tamaño y ubicación de las placas visibles de EM [⇒ Barbosa 1994, ⇒ Lacomis 1986, ⇒ Rinck 1987].
Sin embargo, estas mediciones tampoco son de aplicación clínica.
La disponibilidad de las bases de datos con mediciones in vivo de los tiempos de relajación es muy limitada. La mayor colección de datos fue publicada por Bottomley et al. [⇒ Bottomley 1984, 1987].
Es muy difícil realizar una comparación entre mediciones de relajación in vivo e in vitro porque muchos valores de tiempo de relajación T1 cambian rápidamente después de la extracción. Sólo los tejidos cerebrales revelan un comportamiento de relajación relativamente estable después de haber sido extraídos del cuerpo [⇒ Fischer 1989, 1990].
Después de la infructuosa utilización por parte de los investigadores de valores absolutos de T1 y T2 se comenzaron a utilizar combinaciones de T1 y T2, técnicas de histograma, y sofisticadas técnicas tridimensionales de visualización de representaciones factoriales ("huellas", biomarcadores) [⇒ Skalej 1985].
Las mediciones precisas requieren de largos tiempos de adquisición; el tiempo de repetición, TR, debe ser igual o mayor que 5xT1. En 0,15 T el T1 del miocardio es de alrededor 380 ms, en 1,5 T ha subido a unos 1000 ms. Las mediciones en campos bajos tardan aproximadamente 5 minutos, en campos alto o ultra-altos más de 10, quizás 15 minutos. Así pues, se buscaron y desarrollaron métodos improvisados de adquisición más rápida.
La adquisición rápida de mapas cuantitativos de T1 puede basarse, por ejemplo, en una serie de imágenes instantáneas de disparo rápido de ángulo bajo (FLASH) tras la inversión de la magnetización [⇒ Deichmann 1999].
Estas técnicas se utilizaron, por ejemplo, para estimar la concentración de agentes de contraste paramagnéticos en un órgano.
Dado que la adquisición de datos tisulares cuantitativos de un corazón latiendo tiene que ser muy rápida, últimamente gran parte de la investigación se centra en las modificaciones de una secuencia de RMN pulsada propuesta por David C. Look y Donald R. Locker en 1969. En aquella época no existía la IRM, y Look y Locker utilizaron su método ahorrador de tiempo por ser de un solo paso para espectroscopia de RMN, en lugar de los métodos convencionales para medir el tiempo de relajación T1. El método espectroscópico "LL" estaba dentro del 10% del valor calculado convencionalmente convencionalmente con precisión [⇒ Look 1969].
En la década de los 80, Graumann y sus colegas desarrollaron aún más este método para uso en la IRM [⇒ Graumann 1987].
Siguieron otros y se renunció a la precisión en favor de la velocidad. Entre las secuencias modificadas para resonancia magnética cardiaca y, por ejemplo, cerebral que se utilizan hoy en día experimentalmente (y a veces clínicamente), se encuentran PURR [⇒ Lee 2000], MOLLI [⇒ Messroghli 2004], y ShMOLLI [⇒ Piechnik 2010]. Todas sufren en mayor o menor medida de errores, lo que da lugar a una subestimación del verdadero T1. Los valores T1 'aparentes' de las mediciones MOLLI y ShMOLLI de, por ejemplo, miocardio normal tienen un margen de error del 30% o superior y siempre son más cortos que los valores T1 verdaderos.
También se introdujeron y probaron diversas secuencias de pulsos, como SASHA, SAPPHIRE, DESPOT y muchas otras. Lamentablemente, ninguno de estos valores es fiable ni reproducible (Figura 04-27) [⇒ Bojorquez 2017]. Desde el punto de vista científico y médico, estas mediciones son poco sólidas porque el margen de error es enorme.
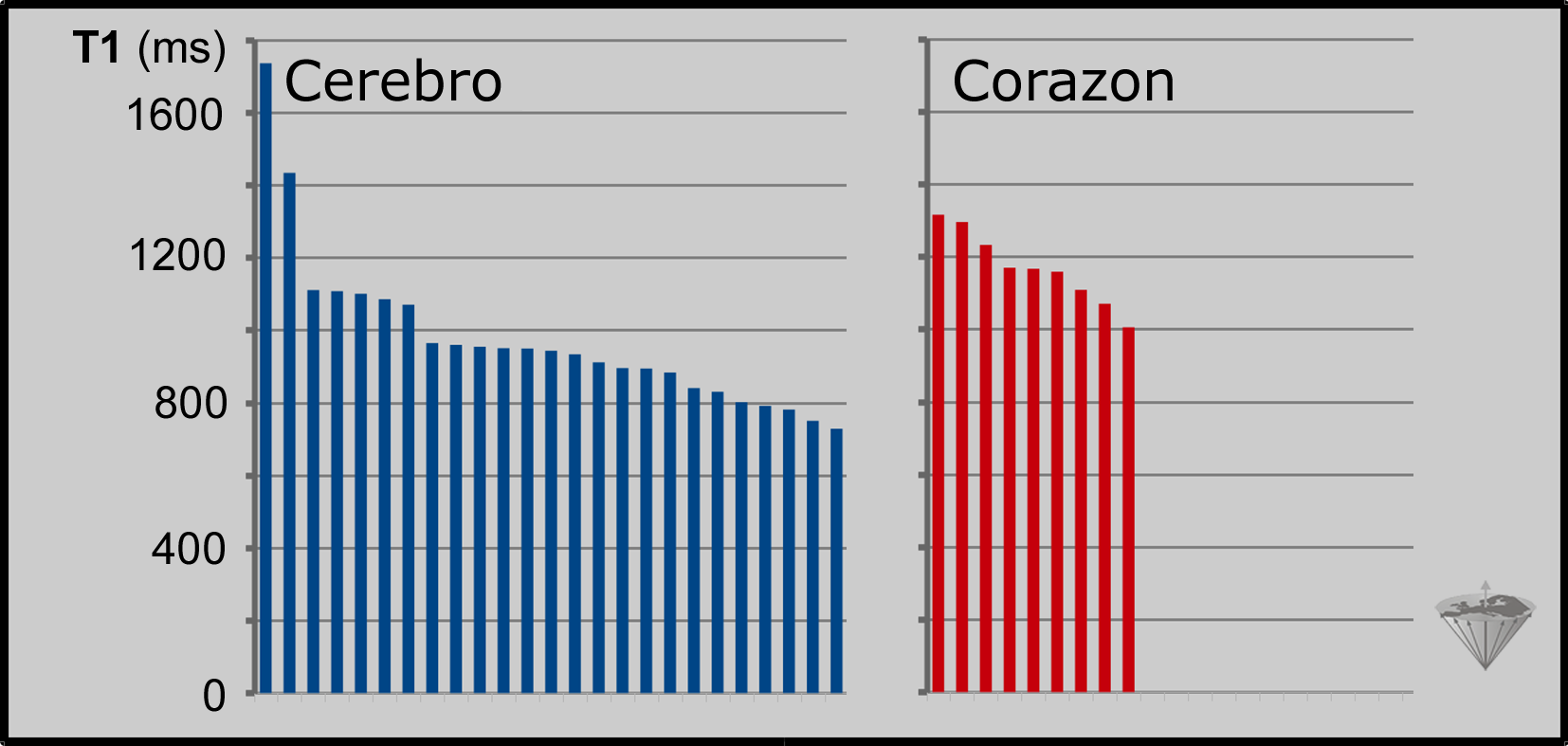
Figura 04-27:
Valores T1 en 3 Tesla de materia gris cerebral humana ("cerebro"; 25 colectivos diferentes) y miocardio ("corazon": 9 colectivos diferentes) medidos in vivo en diferentes máquinas de RM con algoritmos de adquisición de datos acelerados (recopilados de diferentes fuentes). Los valores estimados son imprecisos y se extienden a lo largo de varios cientos de milisegundos.
La brusca caída de los valores de T2* a campos altos y ultra-altos está relacionada con el drástico aumento de los efectos de susceptibilidad magnética, que crecen linealmente con la intensidad del campo magnético; el T2 puro no se ve afectado de la misma manera. El deterioro imperfecto de la magnetización transversal en los ángulos de inclinación (en inglés, flip angles) más altos en las secuencias de eco de gradiente tiene un efecto negativo en la estimación precisa de la intensidad de la señal y de otros parámetros, como los tiempos de relajación [⇒ Zur 1991].
 Observaciones críticas. Sin embargo, al final, ni siquiera es la adquisición de datos más elaborada lo que hace que sea imposible la tipificación de tejidos normales y patológicos ("fingerprinting") o la clasificación de enfermedades, sino más bien la complejidad de la composición tisular y la superposición de los valores del tiempo de relajación de elementos de volumen heterogéneos examinados y procesados en un único número o rango de números.
Observaciones críticas. Sin embargo, al final, ni siquiera es la adquisición de datos más elaborada lo que hace que sea imposible la tipificación de tejidos normales y patológicos ("fingerprinting") o la clasificación de enfermedades, sino más bien la complejidad de la composición tisular y la superposición de los valores del tiempo de relajación de elementos de volumen heterogéneos examinados y procesados en un único número o rango de números.
Es útil mirar una vez con microscopio y ver lo complejas y complicadas que son las estructuras tisulares, tanto en los tejidos normales como en los patológicos — y en los anormales, pero (todavía) no patológicos.
Incluso seguir la moda de cambiar T1 y T2 adquiridos con el mismo equipo y los mismos parámetros de imaginería para calcular los valores de la constante de relajación durante y después del tratamiento de un paciente puede ser como "pescar en aguas turbulentas".
Desde el punto de vista científico, la imaginería por RM es una tecnología rudimentaria y poco exacta. Sin embargo, la imprecisión en medicina no excluye su uso específico.
Un ejemplo es la medición de la sobrecarga cardiaca de hierro, que según varias publicaciones cardiológicas es, hasta ahora, uno de los enfoques diagnósticos más útiles en pacientes con talasemia mayor; sin embargo, muchos artículos sobre el tema son dudosos y los métodos utilizados carecen de base científica. El daño miocárdico en la talasemia está inducido por la deposición de hierro: el hierro libre no unido cataliza la formación de radicales hidroxilos tóxicos para las células. Por lo tanto, el seguimiento del contenido de hierro miocárdico sería útil y podría realizarse mediante la estimación de T2 o T2*.
Para poder discriminar entre un miocardio "normal" y una alteración tisular patológica, el enfoque requiere cambios tisulares masivos, y no puede distinguir entre fibrosis, inflamación y miocardiopatías infiltrativas, edema miocárdico y otras posibles alteraciones de los tejidos. Sin embargo, los valores patológicos de T2* parecen ser altamente reproducibles en diferentes equipos de RM [⇒ Auger 2016].
Otro campo de aplicación de las mediciones de los tiempos de relajación podría ser el seguimiento de los cambios masivos de T1 tras la inyección de un agente de contraste específico, como el Mn-DPDP, y la comparación de tejidos normales y tejidos con contraste, por ejemplo, en cardiopatías (ver: aplicaciones cardíacas del manganeso).
Aquí, también, las mediciones imprecisas pueden tener valor diagnóstico.
Para añadir confusión a una ciencia complicada, los cambios de términos y terminología son habituales en la biociencia contemporánea.
Treinta años después de la descripción de los tiempos de relajación y las tasas de relajación como posibles o, más bien, cuestionables, indicadores biológicos, estos volvieron a situarse entre los marcadores biológicos o biomarcadores.
En general, los biomarcadores son indicadores biológicos de cualquier tipo; hay miles de ellos. No son específicos de la imaginería ni la espectroscopia por RM. Los biomarcadores típicos son mediciones o puntuaciones como la tensión arterial, la temperatura corporal o el índice de masa corporal, o signos clínicos como las manifestaciones externas de una enfermedad. Muchos de ellos son útiles y otros de valor limitado y cuestionable pero aun así utilizados ampliamente.
En la obtención de imágenes por RM, los biomarcadores se dividen en numerosos subgrupos en los que pueden aplicarse de forma aislada o varios combinados, siendo los tiempos de relajación sólo uno de ellos.
Aparte de T1 y T2, existen otros indicadores posibles para la detección, el diagnóstico y el seguimiento del tratamiento, es decir, de estados fisiológicos o de enfermedad concretos.
La cuantificación de los parámetros de RM también se analiza en el Capítulo 15. Los biomarcadores extraídos mediante segmentación de imágenes y análisis multiespectral y los fundamentos de la inteligencia artificial también se describen en el Capítulo 15, los adquiridos con ayuda de agentes de contraste en el Capítulo 13, y mediante imaginería dinámica en el Capítulo 16.